- 160.00 KB
- 4页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档由网友投稿或网络整理,如有侵权请及时联系我们处理。
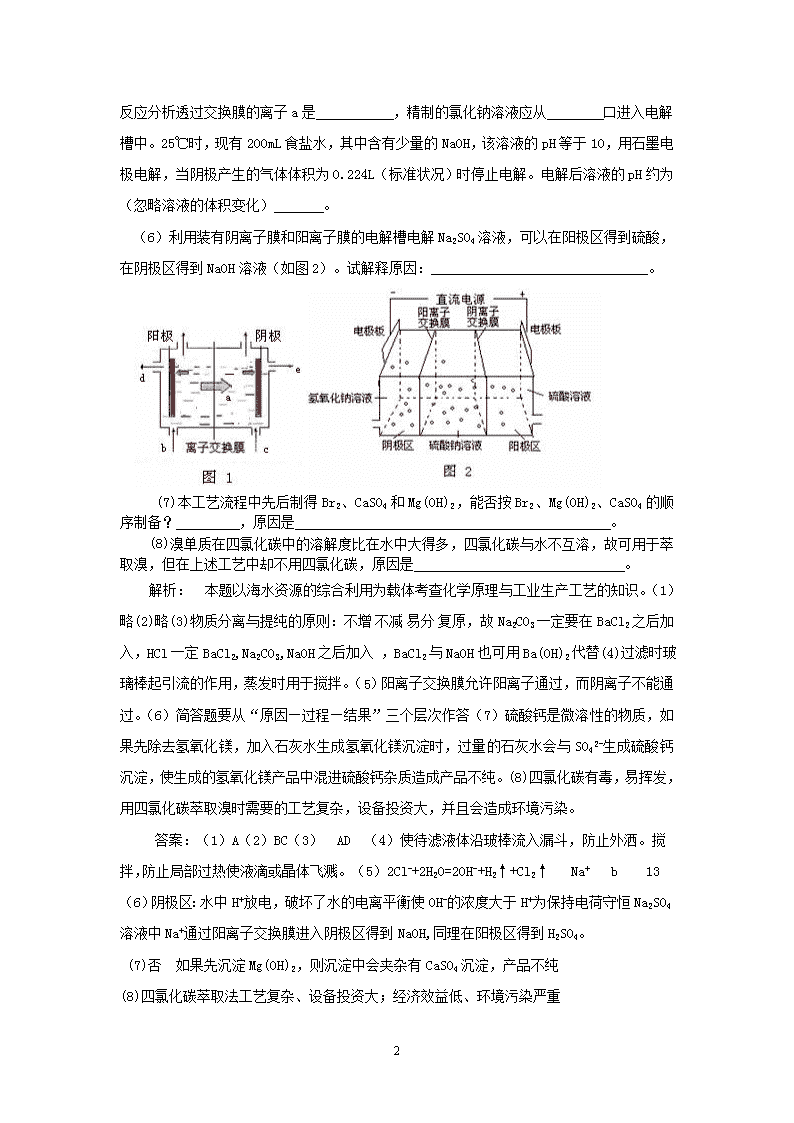
'高考热点解读______海水资源及其综合利用“海水资源利用”是国家重点科技攻关项目之一,对海洋中蕴含的能源、水资源、空间资源等等的合理利用都是关系到未来人类可持续发展的重要环节。所以近十年以“海水资源综合利用”为背景的题目在高考中屡见不鲜。这类题目普遍具有的特点是:题目紧贴科技生产、社会生活,具有鲜明的时代色彩和一定的现实意义,符合对学生进行“人人树立社会可持续发展的意识”教育的要求,属于热点问题。由于海水资源涉及内容比较广:化学物质、能量、生物、矿物及空间资源等等,因而这类题目综合性强,涵盖了高中化学基本概念、基本理论、元素化合物性质、化学实验、化学计算等诸多方面的知识和技能,对学生综合分析能力要求较高。下面结合具体事例加以说明:一、典型例题【例】工业上对海水资源综合开发利用的部分工艺流程如图所示。(1)目前大量制造淡水,大部分使用下列何种方法(A)蒸馏法(B)凝固法(C)离子交换法(D)逆渗透法(2)粗盐中因含有何种成分而易潮解(A)氯化钠(B)氯化镁(C)氯化钙(D)硫酸钙(3)粗盐的提纯有如下实验操作:①加入过量Ba(OH)2溶液、②加入过量NaOH溶液、③加入过量BaCl2溶液、④加入过量Na2CO3溶液、⑤加入过量盐酸、⑥过滤、⑦蒸发结晶。正确的实验操作顺序是_____________A.③②④⑥⑤⑦B.③④②⑤⑦C.②③④⑤⑥⑦D.①④⑥⑤⑦(4)实验室中模拟上述操作,在过滤、蒸发的操作中都要用到玻璃棒,其目的分别是:过滤时:________________________;蒸发时:___________________________。(5)精制的食盐水通过离子交换膜电解槽电解。图1为离子交换膜法电解原理示意图。电解饱和食盐水的离子方程式是4
。试根据电极反应分析透过交换膜的离子a是,精制的氯化钠溶液应从口进入电解槽中。25℃时,现有200mL食盐水,其中含有少量的NaOH,该溶液的pH等于10,用石墨电极电解,当阴极产生的气体体积为0.224L(标准状况)时停止电解。电解后溶液的pH约为(忽略溶液的体积变化)。(6)利用装有阴离子膜和阳离子膜的电解槽电解Na2SO4溶液,可以在阳极区得到硫酸,在阴极区得到NaOH溶液(如图2)。试解释原因:_______________________________。(7)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?,原因是。(8)溴单质在四氯化碳中的溶解度比在水中大得多,四氯化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氯化碳,原因是。解析:本题以海水资源的综合利用为载体考查化学原理与工业生产工艺的知识。(1)略(2)略(3)物质分离与提纯的原则:不增不减易分复原,故Na2CO3一定要在BaCl2之后加入,HCl一定BaCl2,Na2CO3,NaOH之后加入,BaCl2与NaOH也可用Ba(OH)2代替(4)过滤时玻璃棒起引流的作用,蒸发时用于搅拌。(5)阳离子交换膜允许阳离子通过,而阴离子不能通过。(6)简答题要从“原因—过程—结果”三个层次作答(7)硫酸钙是微溶性的物质,如果先除去氢氧化镁,加入石灰水生成氢氧化镁沉淀时,过量的石灰水会与SO42-生成硫酸钙沉淀,使生成的氢氧化镁产品中混进硫酸钙杂质造成产品不纯。(8)四氯化碳有毒,易挥发,用四氯化碳萃取溴时需要的工艺复杂,设备投资大,并且会造成环境污染。答案:(1)A(2)BC(3)AD(4)使待滤液体沿玻棒流入漏斗,防止外洒。搅拌,防止局部过热使液滴或晶体飞溅。(5)2Cl-+2H2O=2OH-+H2↑+Cl2↑Na+b13(6)阴极区:水中H+放电,破坏了水的电离平衡使OH-的浓度大于H+为保持电荷守恒Na2SO4溶液中Na+通过阳离子交换膜进入阴极区得到NaOH,同理在阳极区得到H2SO4。(7)否如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯(8)四氯化碳萃取法工艺复杂、设备投资大;经济效益低、环境污染严重4
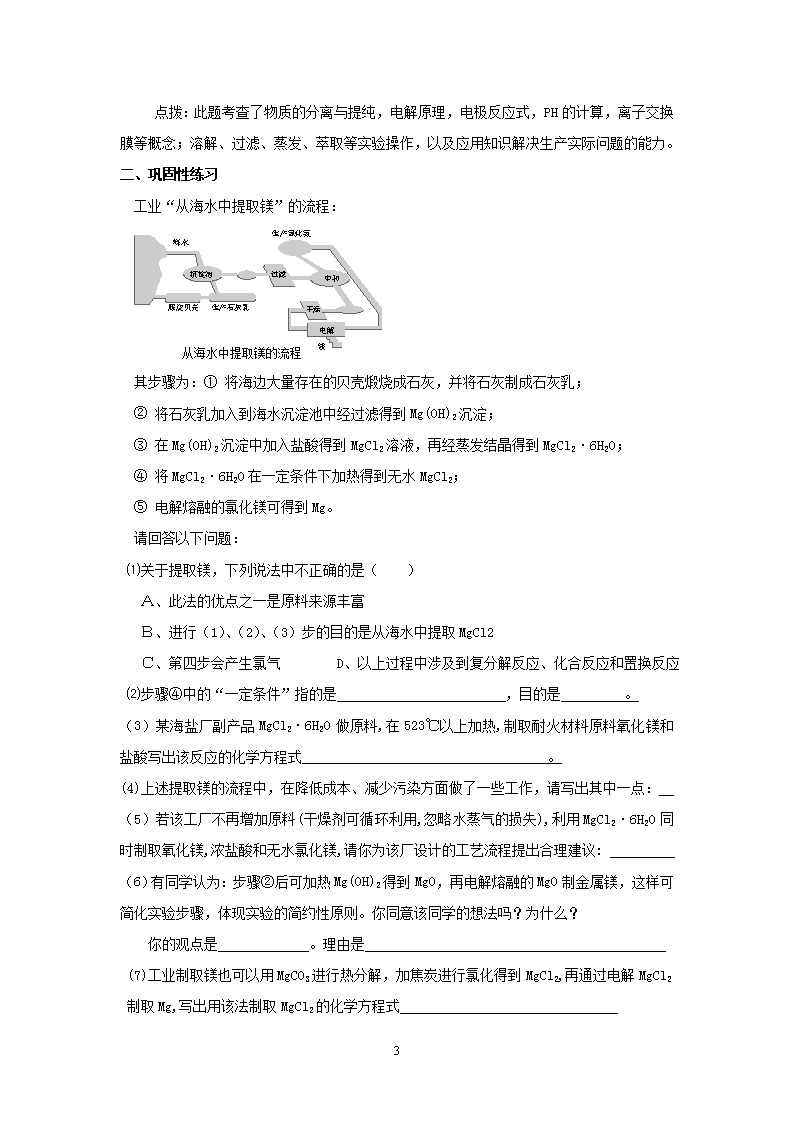
点拨:此题考查了物质的分离与提纯,电解原理,电极反应式,PH的计算,离子交换膜等概念;溶解、过滤、蒸发、萃取等实验操作,以及应用知识解决生产实际问题的能力。二、巩固性练习工业“从海水中提取镁”的流程:其步骤为:①将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;②将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;③在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;④将MgCl2·6H2O在一定条件下加热得到无水MgCl2;⑤电解熔融的氯化镁可得到Mg。请回答以下问题:⑴关于提取镁,下列说法中不正确的是()A、此法的优点之一是原料来源丰富B、进行(1)、(2)、(3)步的目的是从海水中提取MgCl2C、第四步会产生氯气D、以上过程中涉及到复分解反应、化合反应和置换反应⑵步骤④中的“一定条件”指的是,目的是。(3)某海盐厂副产品MgCl2·6H2O做原料,在523℃以上加热,制取耐火材料原料氧化镁和盐酸写出该反应的化学方程式。(4)上述提取镁的流程中,在降低成本、减少污染方面做了一些工作,请写出其中一点:(5)若该工厂不再增加原料(干燥剂可循环利用,忽略水蒸气的损失),利用MgCl2·6H2O同时制取氧化镁,浓盐酸和无水氯化镁,请你为该厂设计的工艺流程提出合理建议:(6)有同学认为:步骤②后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?为什么?你的观点是。理由是(7)工业制取镁也可以用MgCO3进行热分解,加焦炭进行氯化得到MgCl2,再通过电解MgCl2制取Mg,写出用该法制取MgCl2的化学方程式4
答案:(1)C(2)在HCl气流中抑制MgCl2水解成Mg(OH)2(3)MgCl2·6H2O==MgO+2HCl↑+5H2O↑(4)电解产生的Cl2用于制取HCl气体(5)制取氧化镁时生成盐酸,多余氯化氢经干燥后用于制无水氧化镁时的氯化氢气流.(6)不同意因为MgO熔点高,熔融时,耗费大量的能量而增加生产成本。(7)3MgO+2C+3Cl2─→3MgCl2+CO+CO2。4'
您可能关注的文档
- 关于破解城乡水资源短缺和农村饮水安全的实施方案
- 岩寨水电站水资源论证报告(doc 45页)
- 重庆市城区水资源综合规划水资源开发利用情况调查评价(doc 142页)
- 水资源短缺风险综合评价模型_数学建模竞赛参赛论文
- 广东省实行最严格水资源管理制度考核细则
- 甘肃省疏勒河流域水资源管理局水利水电建设工程验收办法
- 地表水资源的开发利用途径及工程
- 鄂尔多斯独贵塔拉工业园区总体规划水资源论证报告书
- 工学水利工程毕业论文 中国水资源优化配置研究的进展与展望
- 海水资源开发利用
- 自然界的水循环和水资源的合理利用学案
- 雨水资源合理利用
- 41 开发利用金属矿物和海水资源_02
- 初三化学第四单元课题1爱护水资源教案(人教版)
- 开发利用金属矿物和海水资源
- 开发利用金属矿物和海水资源_1
- 开发利用金属矿物和海水资源_0
- 爱护水资源教案课件学案同步练习