- 1.04 MB
- 38页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档由网友投稿或网络整理,如有侵权请及时联系我们处理。
'第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法研究物质在紫外-可见光区(200-800nm)分子吸收光谱的分紫外-可见分光光度法的应用:析方法称为紫外-可见分光光度法(UltravioletandVisible•定性上:Spectrophotometry;UV-Vis)。1.鉴别不同官能团和化学结构紫外可见吸收光谱属于电子光谱。由于电子光谱的强度较大,不同的化合物。故UV-vis方法灵敏度较高,一般可达10-4~10-6g/ml,部分可达2.鉴别结构相似的不同化合物。10-7g/ml。准确度一般为0.5%,采用性能较好的仪器其测定准确•定量上:度可达0.2%。1.单一组分的测定。波长范围:(1)远紫外光区:100-200nm岛津UV-2450/25502.多种混合组分不经分离进行同时测定。(2)近紫外光区:200-400nm•可以根据吸收光谱的特性,与其他分析方法配合,用以推断有(3)可见光区:400-800nm机化合物的分子结构。第十二章紫外-可见分光光度法能级跃迁:通常,分子是处在基态振动能级上。当用紫外、可见光照射分电子跃迁与分子吸收光谱(预备知识):子时,电子可以从基态激发到激发态的任一振动(或不同的转动)§物质分子内部三种运动形式:能级上。因此,电子能级跃迁产生的吸收光谱,包括了大量谱线,(1)电子相对于原子核的运动;并由于这些谱线的重叠而成为连续的吸收带,这就是为什么分子的(2)原子核在其平衡位置附近的相对振动;紫外、可见光谱不是线状光谱,而是带状光谱的原因。又因为绝大(3)分子本身绕其重心的转动。多数的分子光谱分析,都是用液体样品,加之仪器的分辨率有限,因而使记录所得电子光谱的谱带变宽。§分子具有三种不同能级:电子能级、振动能级和转动能级§三种能级都是量子化的,且各自具有相应的能量。14e2§分子的内能:电子能量Ee、振动能量Ev、转动能量Er即:E=Ee+Ev+Er3λ250300350400nmΔΕe>ΔΕv>ΔΕr第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法(1)转动能级间的能量差ΔΕr:0.005~0.050eV,产生此能级的跃迁,需吸收波长约为250-25mm的远红外光,吸收光谱位于远(3)电子的跃迁能差约为1-20eV,比分子振动能级差要大几十红外区。形成的光谱称为远红外光谱或分子转动光谱。倍,所吸收光的波长约为12.5-0.06mm,主要在真空紫外到可见光区,对应形成的光谱,称为电子光谱或紫外-可见吸收光谱。(2)分子的振动能级差一般在0.05-1eV,需吸收波长约为25-1.25mm的红外光才能产生跃迁。在分子振动时同时有分子的转动运动。这样,分子振动产生的吸收光谱中,包括转动光谱,故常称为振-转光谱。由于它吸收的能量处于红外区,故又称红外光谱。1PDF文件使用"pdfFactoryPro"试用版本创建www.fineprint.cn
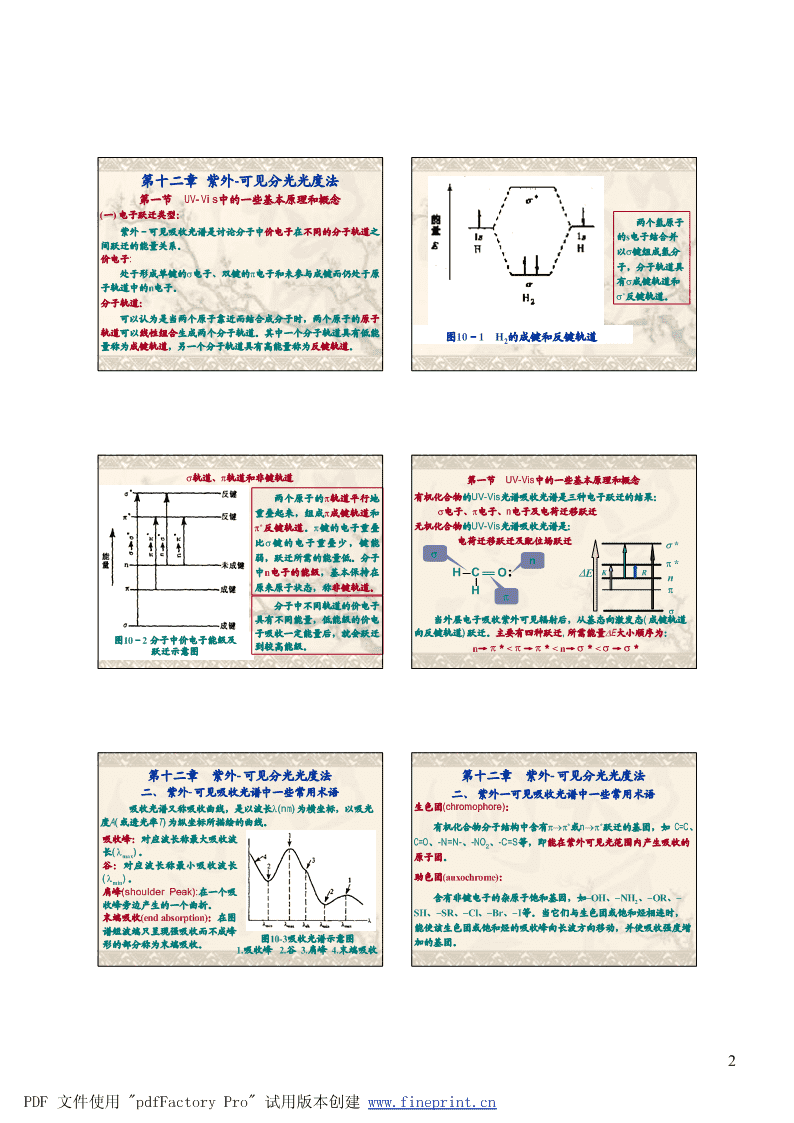
第十二章紫外-可见分光光度法第一节UV-Vis中的一些基本原理和概念(一)电子跃迁类型:两个氢原子紫外-可见吸收光谱是讨论分子中价电子在不同的分子轨道之的s电子结合并间跃迁的能量关系。以s键组成氢分价电子:子,分子轨道具处于形成单键的s电子、双键的p电子和未参与成键而仍处于原有s成键轨道和子轨道中的n电子。s*反键轨道。分子轨道:可以认为是当两个原子靠近而结合成分子时,两个原子的原子轨道可以线性组合生成两个分子轨道。其中一个分子轨道具有低能图10-1H的成键和反键轨道2量称为成键轨道,另一个分子轨道具有高能量称为反键轨道。s轨道、p轨道和非键轨道第一节UV-Vis中的一些基本原理和概念两个原子的p轨道平行地有机化合物的UV-Vis光谱吸收光谱是三种电子跃迁的结果:重叠起来,组成p成键轨道和s电子、p电子、n电子及电荷迁移跃迁p*反键轨道。p键的电子重叠无机化合物的UV-Vis光谱吸收光谱是:比s键的电子重叠少,键能电荷迁移跃迁及配位场跃迁s*弱,跃迁所需的能量低。分子snp*中n电子的能级,基本保持在HCODEKRn原来原子状态,称非键轨道。Hpp分子中不同轨道的价电子s具有不同能量,低能级的价电当外层电子吸收紫外可见辐射后,从基态向激发态(成键轨道子吸收一定能量后,就会跃迁向反键轨道)跃迁。主要有四种跃迁,所需能量DE大小顺序为:图10-2分子中价电子能级及跃迁示意图到较高能级。n→p*C=O、-NO、-NO、-2峰,摩尔吸光系数e一般>104。如丁二烯的l为218nm,maxmaxN=N-等杂原子不饱和发色基团的特征。处于较长波长范围(~e为104就属于K带。max300nm),e一般在100以内。溶剂极性增加,R带发生短移。所max以在非极性溶剂中吸收峰在较长波长处,若改用极性溶剂时,吸收峰短移,说明有R带存在。另外,当有强吸收峰在其附近时,R带有时出现长移,有时被掩盖。3PDF文件使用"pdfFactoryPro"试用版本创建www.fineprint.cn
第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法三、吸收带及其与分子结构的关系三、吸收带及其与分子结构的关系3、B带:从benzenoid(苯的)得名。是芳香族(包括杂芳香族)化合物的特征吸收带。4.E带:苯蒸气在230~270nm处出现精细结构也是芳香族化合物特征吸的吸收光谱,又称苯的多重吸收带)。因在收,认为是由苯环结构中三蒸气状态中分子间彼此作用小,反映出孤立分子振动、转动能级跃迁;在苯溶液中,个环状共轭系统的p®p*跃迁转动消失仅出现部分振动跃迁,因此谱带所产生,分为E1和E2带。两较宽;在极性溶剂中,溶剂和溶质间相互带的吸收峰分别约在180nm作用更大,因而精细结构消失,B带出现和200nm,e为4.7´104和7000。一个宽峰,其重心在256nm附近,e为200都属于强带吸收。左右。图10-4苯异丙烷溶液的紫外吸收光谱图10-4苯异丙烷溶液的紫外吸收光谱第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法三、吸收带及其与分子结构的关系三、吸收带及其与分子结构的关系5、电荷转移吸收带:6、配位体场吸收带:许多无机物(如碱金属卤化物)和某些有机物混合而得的分子络合物,在外来辐射激发下会强烈地吸收紫外光或可见光,过渡金属水合离子或过渡金属离子与显色剂(通常是有机化合物)从而获得可见或紫外吸收带。所形成的络合物,能吸收适当波长的可见光(或紫外光),从而获得相应的吸收带。如Ti(HO)3+水合离子的吸收峰在490nm处。例如:在乙醇介质中,将醌与氢醌混合,可获得醌氢醌暗26绿色结晶,吸收峰在可见光区内。三、吸收带及其与分子结构的关系表10-1一些化合物的电子结构、跃迁和吸收带电子结构化合物跃迁lmax(nm)emax吸收带*s乙烷s®s13510000*n1-己硫醇n®s224120*B,E,K带碘丁烷n®s257486*p乙烯p®p16510000*乙炔p®p1736000*p®p约160R带*p和n丙酮n®s1949000*n®p27915R*p-p丁二烯p®p21721000K*己三烯p®p25835000K*p®p21011500Kp-p和n丙烯醛*图10-5几种常见的紫外与可见吸收光谱n®p31514R4PDF文件使用"pdfFactoryPro"试用版本创建www.fineprint.cn
表10-1一些化合物的电子结构、跃迁和吸收带(续表)第十二章紫外-可见分光光度法电子结构化合物跃迁lmax(nm)emax吸收带三、吸收带及其与分子结构的关系*n®p31514R约18060000E1化合物紫外吸收带可能出现的波长范围及*芳香族p苯芳香族p®p约2008000E2255215B吸收带类型的预测*24412000K芳香族p-pCHCH芳香族p®p282450B芳香族p-sCH3芳香族p®p*2082460E2262174B24013000K芳香族p-p,nCCH3芳香族p®p*O2781110B*n®p31950R芳香族p-nOH*2106200E2芳香族p®p2701450B第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法四、影响吸收带的因素三、吸收带及其与分子结构的关系Ø小结:影响紫外吸收光谱的因素很多,但核心是对分子中电子共轭*结构的影响,可以使吸收带的位置在较宽的波长范围内变动。ü紫外光谱电子跃迁类型:n—π跃迁π—π*跃迁1、位阻影响:ü饱和化合物无紫外吸收化合物中若有两个发色团产生共轭效应,因p电子共轭体系增大,lmax红移,电子离域到多个原子之间,导致p→p*能量降低。ü电子跃迁类型与分子结构及存在基团有密切联系:同时跃迁几率增大,emax增大。•根据分子结构→推测可能产生的电子跃迁类型;但若两个发色团由于立体阻碍妨碍它们处于同一平面上,共轭•根据吸收谱带波长和电子跃迁类型体系被破坏,lmax蓝移,emax减小。→推测分子中可能存在的基团(分子结构鉴定)。第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法四、影响吸收带的因素四、影响吸收带的因素1、位阻影响:1、位阻影响:例二:由于共轭体系延长使得吸收红移,吸收系数增加。例如:取代基越大,分子共平面性越a-鳶尾酮b-鳶尾酮差,因此最大吸收波长蓝移,摩尔吸OO光系数降低。书P189页例子。5PDF文件使用"pdfFactoryPro"试用版本创建www.fineprint.cn
第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法四、影响吸收带的因素四、影响吸收带的因素2.跨环效应:3.溶剂效应:有些b、g不饱和酮中,虽然双键与酮基不产生共轭体系,但溶剂除影响吸收峰位置外,还影响吸收强度和光谱形状。化合由于适当的立体排列,使羰基氧的孤电子对和双键的p电子发生作用,以致使相当于n®p*跃迁的R吸收带向长波移动。同时其吸收强物在溶液中的紫外吸收光谱受溶剂影响较大,所以一般应注明所用度增强。溶剂。如:H2CO溶剂的极性不同,会使n®p*和p®p*跃迁所产生的吸收峰位置在214nm处显示一中等强度的吸收带,同时在284nm处出现一R带。向不同方向移动,改用极性较大的溶剂,一般使p®p*跃迁吸收峰此外,当C=O基团的p轨道与一个杂原子的p轨道能够有效交盖时,也会出现跨环效应。如:向长波方向移动;而使n®p*跃迁吸收峰向短波方向移动,后者的OC移动一般比前者移动大。..S..l238nm,e2535。maxmax第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法四、影响吸收带的因素四、影响吸收带的因素3.溶剂效应:3.溶剂效应:改用极性较大的溶剂,使p®p*跃迁吸收峰长移,是因为激发CH3例如:异丙叉丙酮(CH3CCHC)的溶剂效应见下表态的极性总比基态极性大,因而激发态与极性溶剂之间相互作用所OCH3降低的能量大,所以产生长移。跃迁类型正己烷氯仿甲醇水迁移而在n®p*跃迁中,基态的极性大,非键电子p®p*23Onm238nm237nm243nm长移(n电子)与极性溶剂之间n®p*329nm315nm309nm305nm短移能形成较强的氢键,使基态能量降低大于反键轨道与极性溶剂相互作用所降低的能量,因而跃迁距离变大,故向短移。第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法四、影响吸收带的因素四、影响吸收带的因素3、溶剂的影响:3、溶剂的影响:苯11:乙醚选择溶剂的原则:甲酰2:水在选择紫外吸收光谱分析的溶剂时,应注意如下几点:丙2酮(1)在溶解度允许的范围内,应尽量选用极性较小的溶剂;(2)对试样有良好的溶解能力和选择性,并且形成的溶液具有250300良好的化学和光化学稳定性;非极性→极性:n→p*跃迁:兰移;l¯;e(3)在测定光谱区域,溶剂本身无明显吸收。p→p*跃迁:红移;l;e¯极性溶剂使精细结构消失6PDF文件使用"pdfFactoryPro"试用版本创建www.fineprint.cn
第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法四、影响吸收带的因素五、朗伯-比尔定律:4、体系pH值的影响:体系pH值对紫外光谱的影响是比较普遍的,无论对酸性、碱性或中性物质都有明显的影响。(一)Lambert-Beer定律:例如:酚类化合物由于体系的pH值不同,其解离情况不同,是吸收光度法的基本定律;而产生不同的吸收光谱。是说明物质对单色光吸收的强弱与吸光物质的浓度和厚度间关系的定律。Beer定律说明吸光度与浓度的关系;Lambert定律说明吸光度与厚度的关系。第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法五、朗伯-比尔定律:五、朗伯-比尔定律:透光率的负对数称为吸光度A(absorbance):A=-lgT=lgI0I0=Ia+It+IrIIIt0aIttransmittance吸光度愈大,溶液对光的吸收愈多I溶液对光的吸收除与溶液本性有关外,还与入射光波长、溶液r在实验中,标准物质和被测物质分别置于同样质地和厚度的比色杯浓度、液层厚度及温度等因素有关。中,反射光强度大小近似可相互抵消,所以上式简化为:1760年,Lambert从实验中找到了A与液层厚度的关系式:I0=Ia+ItA=k1l透射光的强度It与入射光的强度I0的比值称为透光率。k1为与被测物性质、入射光波长、溶剂、溶液浓度和温度有关的常数。It当入射光波长、溶剂和吸光物质种类、浓度和溶液的温度都一透光率愈大,溶液对光的吸收愈少。T=I0定时,该溶液的吸光度只与液层厚度成正比。第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法五、朗伯-比尔定律:五、朗伯-比尔定律:1852年,Beer从实验中找到了A与溶液浓度的关系式:A=k2c若浓度的单位改为百分浓度,则A=E1%Cl1cmk2为与被测物性质、入射光波长、溶剂、液层厚度和温度有关的常数。l液层厚度:cm当入射光波长、溶剂和吸光物质种类、液层厚度和溶液的温度百分吸光系数是指在一定波长时,溶液浓度为1%(W/V),厚单位C百分浓度:g/100mL都一定时,该溶液的吸光度只与溶液浓度成正比。度为1cm的吸光度,用E1%表示。1cmE百分吸光系数:(1/100)-1·cm-1合并这两个式子,得到:Lambert-BeerLaw:A=ecl吸光度=吸光系数´介质厚度´浓度摩尔吸光系数是指在一定波长时,溶液浓度为1mol/L,l液层厚度:cm厚度为1cm的吸光度,用e单位c物质的量浓度:mol·L-1表示。e摩尔吸光系数:L·mol-1·cm-17PDF文件使用"pdfFactoryPro"试用版本创建www.fineprint.cn
第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法五、朗伯-比尔定律:五、朗伯-比尔定律:A=-lgT=elc=E1%Cl1cm透光度T:描述入射光透过溶液的程度:吸光系数—吸光物质在单位浓度和单位厚度时的吸光度—物质的特T=It/I0性常数。吸光系数越大,物质的吸光能力越强,测定灵敏度越高。吸光度A与透光度T的关系:A=-lgT换算关系:e=E1%Me比E1cm1%更常用。1cm´10Lambert-BeerLaw:M为吸光物质的摩尔质量。A=ecle的变化范围从几到105,从量子力学观点考虑:若跃迁是完全允许的,e>104,强吸收©朗伯—比耳定律是吸光光度法©摩尔吸光系数ε在数值上等于若跃迁概率低,e<103,中强吸收的理论基础和定量测定的依据。浓度为1mol/L、液层厚度为1cm若跃迁是禁阻的,e<102,弱吸收应用于各种光度法的吸收测量。时该溶液在某一波长下的吸光度。第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法五、朗伯-比尔定律:五、朗伯-比尔定律:例题:已知含铁(Fe2+)为1.0mg/mL的溶液,用邻二氮菲分光光度1%吸光系数e或E1cm不能直接测得,需用已知准确浓度的稀溶法测定。吸收池厚度为2cm,在510nm处测得其透光率为0.417,求液测得吸光度换算而得到。吸光度A及摩尔吸收系数e(Fe2+的摩尔质量为55.85g/mol)。例如:氯霉素(M为323.15)的水溶液在278nm处有吸收峰。设用A=-lgT=-lg0.417=0.380纯品配制100ml含有2.00mg的溶液,以l.00cm厚的吸收池在278nmc=1.0´10-3/55.85=1.8´10-5mol/L处测得透光率为24.3%。则吸收系数为:e510=A/lc=0.380/2´1.8´10-5=1.06´104L/mol•cmE1%=-lgT=0.614=307323.151%9920E1%=A/lc=1.06´104´10/55.85=18971cmCl0.002e=´E1cm=1cm10第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法五、朗伯-比尔定律五、朗伯-比尔定律:朗伯-比尔定律推导:如果溶液中同时存在两种或以上的吸光物质,只要共存物质不互相影响性质,即不因共存物而改变本身的吸光系数,则总吸光度是各共存物吸光度的加和,如下式:A总l=Al1+Al2+A3l+¼Aln光束在每单位时间内所传输的能假设一束平行单色光通过一个含有吸光物质的物体,截面积为s,量或光子数是光的功率(辐射功率),厚度为l,见上图。物体中含有n个可用符号P表示。吸光质点(原子、离子或分子)。光在光度法中,习惯上用光强这一通过此物体后,一些光子被吸收,名词代替光功率,并以符号I代表。光强从I降低至I。08PDF文件使用"pdfFactoryPro"试用版本创建www.fineprint.cn
第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法朗伯-比尔定律推导:五、朗伯-比尔定律朗伯-比尔定律推导:光子通过断层时,被吸收的几率是:dskdn=ss因而使投射于此断层的光强I被减弱了dI,所以:xxdIxkdn-=如物体中一个极薄的断层中所含吸光质点数为dn,这些能捕获光子Ixs的质点可以看作截面s上被占去一部分不让光子通过的面积ds,即:ds=kdn(10-1)第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法五、朗伯-比尔定律五、朗伯-比尔定律朗伯-比尔定律推导:朗伯-比尔定律推导:由此可得,光通过厚度为l的物体时,有:上式中I/I0是透光率(transmitance,T),常用百分数表示;IdIxnkdnIkn又以A代表-lgT,并称之为吸光度(absorbance),于是:-ò=ò-ln=I0Ix0sI0s-A-EClA=-lgT=ECl,T=10=10Inn(10-4)-lg=lge×k×=E×I0ss(10-2)单色光通过吸光介质后,T与C或l之间呈指数函数关系。而吸又因截面积s与体积V,质点总数n与浓度C等有以下关系:光度与浓度或厚度之间是简单的正比关系,其中E是比例常数,称VnI为吸光系数(absorptivity)。s=,n=V×c;=l×C,-lg=ECllsI0第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法五、朗伯-比尔定律五、朗伯-比尔定律朗伯-比尔定律:(二)偏离Beer定律的因素:按照Beer定律,浓度C与吸光度A之间A=-lgT=ECl,T=10-A=10-ECl关系应是一条通过原点的直线。(10-4)事实上,浓度C与吸光度A之吸光系数E表示吸光物质在单位浓度及单位厚度时的吸光度。间关系往往容易发生偏离而引入在给定单色光、溶剂和温度等条件下,吸光系数是物质的特性常误差。导致偏离的主要原因有化数,表明物质对某一特定波长光的吸收能力。学方面和光学方面的因素。物质吸光系数愈大,表明该物质的吸光能力愈强,所以吸光系1.化学因素:溶质浓度改数是定性和定量依据。变而有离解、缔合与溶剂间的作用等而偏离Beer定律。9PDF文件使用"pdfFactoryPro"试用版本创建www.fineprint.cn
五、朗伯-比尔定律第十二章紫外-可见分光光度法五、朗伯-比尔定律(二)偏离Beer定律的因素:(二)偏离Beer定律的因素1.化学因素:1.化学因素又例如:重铬酸钾的水溶液有以下平衡:CrO2-+HO=2H++2CrO2-。2724溶液中CrO42-、Cr2O72-的颜色不同,吸光性质也不相同。故此时溶液pH对测定有重要影响。若溶液稀释2倍,CrO2-离子浓度27不是减少2倍,而是受稀释平衡向右移动的影响,CrO2-离子浓度的减少明显27地多于2倍,结果偏离Beer定律,而产图10-9亚甲蓝阳离子水溶液的吸收光谱生误差。(a)6.36´10-6mol/L(b)1.27´10-4mol/L(c)5.97´10-4mol/L第十二章紫外-可见分光光度法第十二章紫外-可见分光光度法五、朗伯-比尔定律五、朗伯-比尔定律(二)偏离Beer定律的因素(二)偏离Beer定律的因素2.光学因素2.光学因素(1)非单色光:Beer定律的一个重要前提是入射光是单色光,但这事实上是难以做到的。例如,若光源为连续光谱,常把所需要的波长从光源的光中分离出来,其波长宽度决定于单色器中的狭缝宽度和棱镜或光栅的分辨率。狭缝必须有一定宽度,使分离出来的光是具有一定波长范围的光。这一宽度称为谱带宽度(bandwidth),谱带宽度S越小,常用半峰宽来表示。单色性越好。图10-10单色光的谱带宽s=l-l21五、朗伯-比尔定律五、朗伯-比尔定律(二)偏离Beer定律的因素(二)偏离Beer定律的因素2.光学因素2.光学因素I+I×10(E1-E2)Cl偏离Beer定律的主要原因是由于物质对不同波长的光有不同A=-lgT=ECl-lg0102(10.6)1I+I的吸光系数。例如:设被测物对波长为l与l两种光的吸光系数为010212E与E。测定时,两种光各以强度为I与I同时入射试样。则:E1¹E2时,A与C之间的关系不符合Beer定律。假若l1是所需120102光的波长,则l的光所产生的影响将是:I+II×10-E1Cl+I×10-E2Cl2T=12=0102E>E时,使吸光度降低,产生负偏差;I01+I02I01+I0212I+I×10(E1-E2)ClE1C=C<乙烯气态17110000-CºC-乙炔气态1736000(一)有机化合物的紫外吸收光谱>C=O乙醛气态28912.516020000含孤立生色团化合物:18210000>C=O丙酮正己烷194900会产生n®p*和n®s*跃迁,因含杂原子双键,故还会产生气态15616000正己烷27915p®p*跃迁,孤立双键的p®p*吸收峰在150~180nm之间。-COOH乙酸水20440-COOR乙酸乙酯水20460酮和醛有三个吸收峰:n®s*跃迁吸收峰在190nm左右,p®p*-CONH2乙酰胺甲醇205160-COCl乙酰氯庚烷24034吸收峰在150~180nm之间,n®p*吸收峰在275~295年nm之间。>C=N-丙酮肟水1905000-N=N-偶氮甲烷二氧六环3474.5乙醚300100-N=O亚硝基丁烷665-NO2硝基甲烷乙醇271186第三节紫外-可见分光光度分析法第三节紫外-可见分光光度分析法五、有机化合物分子结构分析五、有机化合物分子结构分析(一)有机化合物的紫外吸收光谱(一)有机化合物的紫外吸收光谱3.共轭烯烃:4、a,b不饱和酮、醛、酸和酯:在同一分子中有两个双键,其间有两个以上次甲基隔开,则它若双键和羰基未形成共轭化合物,其紫外光谱分别呈现C=C和们的吸收峰位置与只含一个双键的吸收峰位置相同,只是吸收强度C=O双键的p®p*跃迁,约在200nm附近有两个强吸收峰,另外在约增加一倍。约280nm处有羰基的n®p*吸收峰。若分子中两个双键间只隔一个单键则成为共轭系统,生成大p但在a,b不饱和醛、酮中,由于C=O和C=C基共轭,使p®p*键,使p与p*间能级距离变小,吸收峰长移,吸收增强。随着共轭长移至200~260nm,e约为10000。而n®p*跃迁长移到310~体系增加p®p*跃迁所需能量减小,吸收峰长移增加,e增大,化350nm,e
您可能关注的文档
- gbt 1 4423-1993 锅炉用水及冷却水分析方法 2-巯基苯骈唑的测定 紫外分光光度法
- gbt 1 4425-1993 锅炉用水及冷却水分析方法 硫化氢的测定 分光光度法
- gb 10 656-1989 锅炉用水及冷却水分析方法 锌离子的测定 锌试剂分光光度法
- gbt 1 4426-1993 锅炉用水及冷却水分析方法 亚硫酸盐的测定 分光光度法
- gb 12 153-1989 锅炉用水及冷却水分析方法 油的测定 紫外分光光度法
- 分光光度法 测定锅炉水中二氧化硅的技术研究
- hj-t 345-2007 水质 铁的测定 邻菲啰啉分光光度法(试行)
- 分光光度法测定_淀粉酶活性_涂祖新
- 分光光度法测定植物油脂中氯化物含量
- n,n-二乙基对苯二胺分光光度法测定饮用水中的游离余氯
- 分光光度法测定水中总磷的若干影响因素
- 分光光度法测定水中溶解氧.textmark
- 分光光度法测定油田水样中的硫酸根离子
- 分光光度法间接测定钢铁及水样中的微量磷[1]
- 油田水质分析-邻菲罗啉分光光度法测定水样中的铁
- 正磷分析方法(分光光度法)
- 紫外分光光度法操作规程
- 甲醛的检验方法 ahmt分光光度法