- 333.50 KB
- 7页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档由网友投稿或网络整理,如有侵权请及时联系我们处理。
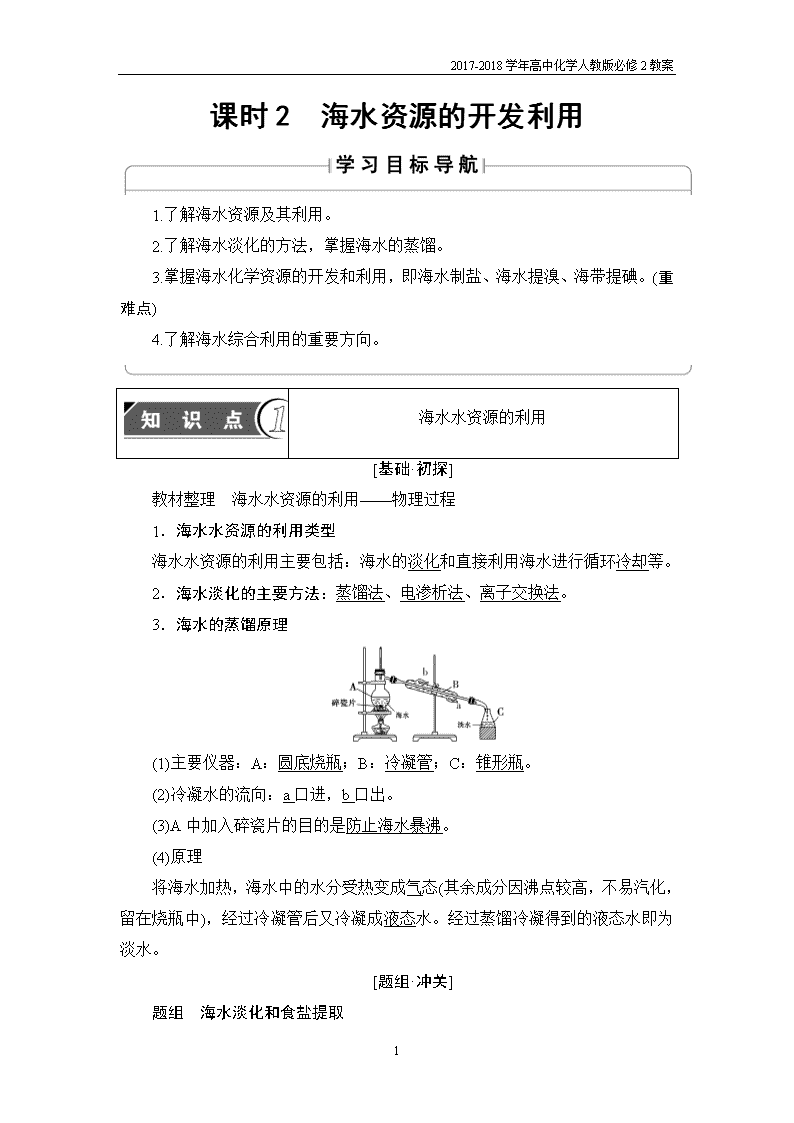
'2017-2018学年高中化学人教版必修2教案课时2 海水资源的开发利用1.了解海水资源及其利用。2.了解海水淡化的方法,掌握海水的蒸馏。3.掌握海水化学资源的开发和利用,即海水制盐、海水提溴、海带提碘。(重难点)4.了解海水综合利用的重要方向。海水水资源的利用[基础·初探]教材整理 海水水资源的利用——物理过程1.海水水资源的利用类型海水水资源的利用主要包括:海水的淡化和直接利用海水进行循环冷却等。2.海水淡化的主要方法:蒸馏法、电渗析法、离子交换法。3.海水的蒸馏原理(1)主要仪器:A:圆底烧瓶;B:冷凝管;C:锥形瓶。(2)冷凝水的流向:a口进,b口出。(3)A中加入碎瓷片的目的是防止海水暴沸。(4)原理将海水加热,海水中的水分受热变成气态(其余成分因沸点较高,不易汽化,留在烧瓶中),经过冷凝管后又冷凝成液态水。经过蒸馏冷凝得到的液态水即为淡水。[题组·冲关]题组 海水淡化和食盐提取7
2017-2018学年高中化学人教版必修2教案1.下列是四位同学对于海水淡化供居民用水所提供的方法,其中原理上完全不可行的是( )【解析】 海水淡化的方法:蒸馏法、电渗析法、离子交换法。选项A,明矾的主要成分是KAl(SO4)2·12H2O,加明矾不能使海水中的盐沉淀出来,所以不能使海水淡化。【答案】 A2.中国食盐产量居世界首位。下列实验室中的操作类似“海水晒盐”原理的是( )A.蒸馏B.蒸发C.过滤D.搅拌【解析】 实验室中的“蒸发”操作是利用水受热易挥发的特点,其中的溶质因溶剂减少而析出的过程,这与海水晒盐的原理是类似的。【答案】 B【题后归纳】 海水淡化的方法和原理方法原理蒸馏法将海水加热至沸腾汽化,然后将蒸气冷凝而得到蒸馏水电渗析法在外加直流电场作用下,利用阴、阳离子交换膜对水中阴、阳离子的选择透过性,使水中的一部分离子转移到另一部分水中而达到除盐的目的离子交换法用阳离子交换树脂和阴离子交换树脂除去海水中的阴、阳离子,得到去离子水海水化学资源的开发利用[基础·初探]1.海水中的化学元素7
2017-2018学年高中化学人教版必修2教案(1)(2)特点:种类很多,总储量很大,但许多元素的富集程度很低。2.海水化学资源的开发利用海水提碘①流程:海带灼烧→浸泡→过滤→氧化→萃取→提纯→碘单质②主要的化学原理:2I-+H2O2+2H+===I2+2H2O(写出离子方程式)海水提溴①方法:在预先经过酸化的浓缩海水中,用Cl2氧化溴离子使之成为溴单质②主要的化学原理:Cl2+2NaBr===Br2+2NaCl其他能量的利用①提取核能开发中的重要原料铀和重水②开发海洋药物③潮汐能、波浪能等有待开发的新型能源[题组·冲关]题组1 海水中提取Na、Mg1.NaCl是从海水中提取出来的一种重要物质,除食用外,它还是一种工业原料,下列以NaCl为原料的产品(物质)是( )①烧碱 ②纯碱 ③金属钠 ④氯气 ⑤盐酸A.①②③④⑤B.①②③④C.①②③⑤D.①②④⑤【解析】 电解NaCl的水溶液可制得NaOH、H2、Cl2;H2、Cl2可合成HCl;NaCl溶液又可与CO2、NH3反应来制取NaHCO3;NaHCO3热分解可得Na2CO3,电解熔融的NaCl可制备金属钠。【答案】 A2.从海水中可提取多种化工原料,下面是工业上对海水资源综合利用的示意图。试回答下列问题:7
2017-2018学年高中化学人教版必修2教案(1)粗盐中含有Ca2+、Mg2+、SO等杂质离子,精制时所用试剂为A.盐酸;B.BaCl2溶液;C.NaOH溶液;D.Na2CO3溶液。则加入试剂的顺序是________(填字母)。(2)写出用海滩上的贝壳制Ca(OH)2的化学方程式:______________________________________________________________________________________________________________________________。(3)电解无水MgCl2可制取镁和Cl2,其中副产品Cl2和Ca(OH)2可制得漂白粉。制漂白粉的化学方程式为______________________________________________________________________________________________________________________________。(4)用海滩上的贝壳制Ca(OH)2,而不从异地山中开凿石灰石制取,主要考虑到什么问题?_______________________________________________________________。(5)从经济效益角度看,该化工厂厂址应选在______________________________________________________________________________________________________________________________。【解析】 化工生产是综合利用化学知识解决实际问题的过程,在此过程中,除运用到我们所学的化学知识外,还要从环境保护、能源利用、经济效益等方面考虑。(1)该小题属离子除杂题。除杂原则是在除去Ca2+、Mg2+、SO时,不能带入新的杂质离子。所以,解此题的关键是把握好加入离子的顺序:①Ba2+必须在CO之前加入;②CO、OH-必须在H+之前加入,所以B、C不分先后,而D、A本身既分先后,A又必须放在B、C之后才能满足条件。(2)由贝壳→Ca(OH)2的反应为CaCO3→CaO→Ca(OH)2。(3)漂白粉的主要成分为CaCl2和Ca(ClO)2,可将Cl2通入石灰乳中制得。7
2017-2018学年高中化学人教版必修2教案(4)海滩上的物质为海水综合利用创造了便利条件,不用运输,就地取材,从经济效益角度考虑是有利的。(5)由此可见,应在海滩建化工厂或在沿海陆地建厂。【答案】 (1)BCDA(或CBDA)(2)CaCO3CaO+CO2↑,CaO+H2O===Ca(OH)2(3)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O(4)经济效益 (5)海边题组2 海水中提取溴与碘3.某课外小组将灼烧海带产生的灰烬浸泡后过滤,得到澄清的滤液。他们设计了如下的几个方案,你认为能证明海带的灰烬中含有碘元素的是( )A.取适量滤液,蒸干,观察是否有紫色固体生成B.取适量滤液,加入苯,振荡,静置,苯层无色,证明不含碘元素C.取适量滤液,向其中加入淀粉溶液,无明显现象,证明不含碘元素D.取适量滤液,加入酸化的H2O2,再加入淀粉溶液,呈蓝色,证明含有碘元素【解析】 海带的灰烬中含有的碘元素,是以I-形式存在的,不是以单质形式存在,所以A、B、C均不正确;D中发生了氧化还原反应:H2O2+2I-+2H+===I2+2H2O,产生了I2,使淀粉溶液呈蓝色。【答案】 D4.海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示:(1)请列举海水淡化的一种方法7
2017-2018学年高中化学人教版必修2教案______________________________________________________________________________________________________________________________。(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_______________________________________________________________。(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,该反应的离子方程式为_______________________________________________________________,由此反应可知,除保护环境外,在工业生产中还应解决的问题是_______________________________________________________________。【解析】 步骤Ⅰ中Br2的浓度很小,多次用SO2反复吸收,最终用Cl2处理,则可获得大量的工业溴。溴具有强氧化性,可以氧化SO2生成H2SO4,因此要注意强酸和溴对设备的腐蚀问题。【答案】 (1)蒸馏法(或电渗析法、离子交换法)(2)富集Br2,提高Br2的浓度(3)SO2+2H2O+Br2===4H++2Br-+SO 强酸和溴对设备的腐蚀版权所有:高考资源网(www.ks5u.com)7
2017-2018学年高中化学人教版必修2教案7'
您可能关注的文档
- 41 开发利用金属矿物和海水资源 (第1课时) 课件 人教
- 吉安水资源质量月报
- 毕业论文(设计)--北京市水资源短缺风险综合评价数学建模论文.doc
- 淄博市水资源保护规划
- 上海市水资源承载力的评价分析_地理信息系统(gis)
- 浙江省水资源保护规划技术大纲
- 论水资源法律调整模式及其变迁
- 论水资源承载能力与水资源优化配置之间的关系(
- 纪要全国纪要全国水资源保护_十二五_规划工作会议
- 西北山区农村水资源稀缺状况的社会学调查_以甘肃省通渭_静宁县交界村庄张家山为例
- 科研基地建设-北京实验室-北京水资源安全北京实验室项目
- 一 水是宝贵的资源 节约用水、保护水资源
- 经济部水资源统一规划委员会组织条例
- 课题1爱护水资源ppt
- 佛山市水资源开发利用情况探讨
- 水资源税纳税人调查确认表
- 水资源高效利用与工程安全
- 水资源统计调查报告2007